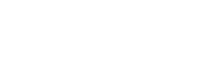Litij, ki poganja mobilni svet
Komponenta vseh prenosnih elektronskih naprav, ki se na videz že dolgo časa ni opazneje spremenila, so baterije. Navadno nas razočarajo ravno takrat, ko telefon najbolj potrebujemo, obenem pa predstavljajo največjo coklo v razvoju. A v resnici je razvoj na tem področju silovit, le da se za običajnega uporabnika praviloma zvede v eno samo številko.
Prvi zanesljivi viri električne energije v zgodovini so bile prav primitivne baterije, medtem ko so pred tem eksperimentirali z različnimi načini za shranjevanje statične elektrike. Generatorji izmeničnega toka in distribucijska omrežja so morali na iznajdbo počakati še kar nekaj desetletij.
Luigi Galvani je konec 18. stoletja odkril, da žabji kraki trznejo, če se jih hkrati dotakne z elektrodama iz medenine (zlitina bakra in cinka) in železa, a še ni razumel, kaj je vir tega trzljaja. Alessandro Volta je leta 1800 iznašel prvo baterijo, in sicer je v raztopino soli potopil diske iz različnih kovin, ko so bili ločeni s porozno tkanino. Dobili smo prvi vir električne energije, ki pa je bil nepraktičen, nevaren in kratke življenjske dobe. Vse to je izboljšal John Daniell, ki je raztopini bakrovega sulfata in žveplene kisline ločil z lončeno posodo, tako da so ioni lahko prehajali iz ene raztopine v drugo. Elektrodi sta bili bakrena posoda in cinkova ploščica.

Voltova baterija z začetka 19. stoletja je sestavljena iz cinkovih in bakrenih diskov, potopljenih v slanico, ki jih ločuje klobučevina. Eno celico sestavljata sosednja diska. Fotografija: Daniele Pugliesi (CC-BY-SA)
V tem kratkem pregledu omenimo samo še svinčevi akumulator, ki je bil prvi primer baterije, ki jo je bilo mogoče napolniti. V žvepleni kislini sta pomočeni elektrodi iz svinčevega(IV) oksida in svinca, ki se pri praznjenju akumulatorja raztapljata v svinčev(II) sulfat(VI), pri polnjenju pa obnavljata.
Za uporabo v prenosnih napravah pa je bilo treba izumiti baterije, ki so se dale napolniti, a so zmogle shraniti več energije na manjšem prostoru in niso vsebovale tekočine. Poznamo jih več vrst, daleč najpogosteje pa danes uporabljamo nikelj-metalhidridne (NiMH) in litij-ionske (Li-ion).
Daniellov člen je šolska različica galvanskega člena oziroma baterije. Med praznjenjem se cinkova ploščica raztaplja v raztopini lastnih ionov, na bakrovo ploščico pa se nalaga dodaten baker, ko se reducirajo bakrovi ioni iz raztopine. Člen se izprazni, ko enih ali drugih (skoraj) zmanjka. Vir: McMurry, Fay – Chemistry
Kemija
Današnje baterije nimajo skorajda nič skupnega z galvanskim členom, ki ga v šolah rišejo pri osovraženi kemiji. Skupni so le osnovni pojmi. Baterija je naprava za shranjevanje električne energije v obliki kemične energije, kar se dogaja z reakcijami redukcije (sprejemanje elektronov) in oksidacije (oddajanje elektronov). Vsaka baterija je sestavljena iz več celic, ki so med seboj zaporedno zvezane, načeloma pa si lahko vsako predstavljamo kot majhno baterijo. Več jih uporabljamo zato, ker ima posamezna celica prenizki napetost in kapaciteto.
V celici najdemo negativno in pozitivno elektrodo, med katerima je elektrolit. Poimenovanje elektrod je v fiziki in kemiji stalen problem, zato razčistimo takoj na začetku. Katoda je vedno elektroda, na kateri poteka redukcija, na anodi pa teče oksidacija. To pomeni, da je, tehnično gledano, pri praznjenju baterije katoda pozitivno, anoda pa negativno nabita. Pri polnjenju baterije tečejo tok in kemične reakcije v nasprotni smeri, a zaradi enostavnosti oznaki katode in anode ohranimo, četudi to ni povsem pravilno. Pri praznjenju baterije torej elektroni z negativno nabite anode prek električnega vezja in porabnika tečejo na katodo. Hkrati v isti smeri, a skozi elektrolit, tečejo tudi pozitivno nabiti ioni, da sistem ostane elektronevtralen. Če ste izbrali reakcije, ki jih je mogoče z zunanjim siljenjem toka v nasprotno smer obrniti, ste dobili polnilno baterijo oziroma akumulator.
Pogosto vprašanje je, zakaj baterije sploh delujejo. Če odmislimo visokoletečo kemijo in elektronske potenciale, je razlog zelo preprost. V bateriji imamo spojine in elemente, ki želijo med seboj reagirati, a so ločeni s polprepustno membrano in povezani prek porabnika. V primeru svinčevega akumulatorja želita svinec in svinčev(IV) oksid zreagirati v svinčev(II) sulfat(VI), pa tega ne moreta preprosto storiti, ker nista v neposrednem stiku. Reakcija zato teče z izmenjavo elektronov in ionov, vsak fizik pa vam zna povedati, da je kontinuirana izmenjava elektronov električni tok.
Da bo baterija dolgo živela
Da bi podaljšali življenjsko dobo baterije, velja upoštevati naslednje nasvete, pri čemer je treba pri vsakem pretehtati, koliko nam pomeni udobje in koliko daljša življenjska doba baterije.
• Uporaba kakovostnih in vrsti baterije primernih polnilcev. V polnilcih, ki lahko polnijo več baterij naenkrat, in napravah uporabljamo hkrati le baterije istega modela (in če je mogoče z isto zgodovino); tako se izognemo pregloboki izpraznitvi slabše baterije, medtem ko dobra še deluje.
• Izogibanje prenapolnjenju baterije, raje kakšen odstotek manj kot preveč (vsakih 0,1 V nižja napetost podvoji število ciklov, ki jih zdrži Li-ion baterija). Polnilci so optimizirani za čim večjo kapaciteto baterije, ne pa za dolgoživost.
• Odstranitev baterij iz prenosnikov, ki so ves čas na omrežni napetosti. • Čeprav so polnilci dovolj pametni, da baterijo odklopijo, ji škodujejo visoke temperature v prenosniku.
• Izogibanje popolni izpraznitvi Li-ionskih baterij; skladiščenje 40-odstotno polnjenih na hladnem in suhem prostoru.
• Izogibanje prekinitvi polnilnih ciklov NiMH baterij; skladiščenje praznih v hladnem in suhem prostoru.
• Uporaba različnih programov za ponastavljanje baterij (reconditioning) navadno povzroči več škode kot koristi.
• Izogibanje temperaturam nad 30° C. Čeprav baterije na prvi pogled pri višji temperaturi delujejo bolje, je to le zato, ker je kemijski potencial in s tem napetost tedaj višja, to pa krmilna elektronika zazna kot višjo kapaciteto. V resnici baterija ni nič bolj polna, ji pa dolgoročno zelo škodujejo visoke temperature. Oživljanje prazne baterije na radiatorju je nadvse škodljivo.
• Enkrat na mesec pustite napravo z baterijo, da se popolnoma izprazni, in jo znova napolnite. S tem zmanjšate možnost za nastanek kristaliničnih struktur na elektrodah oziroma raztopite že nastale.
• Sprijaznite se, da boste morali v vsakem primeru najpozneje čez štiri leta kupiti novo baterijo.
Lastnosti baterij
Baterije delimo na primarne in sekundarne, kjer je glavna razlika ta, da moramo prve po uporabi zavreči, druge pa lahko znova napolnimo. Primarne baterije najdemo v urah, daljincih in podobnih napravah z nizko porabo energije, drugod pa je gospodarneje uporabljati sekundarne baterije oziroma akumulatorje.
Čeprav končnega uporabnika zanima le, kako dolgo bo njegova naprava zdržala z enim polnjenjem baterije, imajo baterije vrsto značilnosti. Napetost baterije je odvisna od števila celic in napetosti posamezne celice. Ta je odvisna od uporabljenih elektrod, vrste elektrolita in koncentracije. Ker se koncentracija posameznih zvrsti med praznjenjem baterije spreminja, njena napetost s praznjenjem pada, kar merimo, ko nas zanima njena napolnjenost. S staranjem napetost baterije pada, to mnogokrat zamenjujejo s spominskim učinkom (glej okvir).
Kapaciteta baterije je odvisna od količine naboja, ki jo baterija shrani, in pri popolnem praznjenju v obliki koristnega dela porine skozi porabnik. Naboj enega elektrona je 1,6 · 10-19 As. Teoretično kapaciteto lahko izračunamo iz poznavanja kemijskih reakcij, ki tečeta na obeh elektrodah v členu, saj pri zapisu vidimo, koliko elektronov odda ali sprejme elektroda. Pomembna je specifična kapaciteta glede na maso, ki jo izračunamo iz poznavanja molske mase reaktantov, upoštevati pa moramo še mrtvo maso elektrolita, ohišja in drugih neaktivnih komponent v bateriji.
S kapaciteto je povezana energija, ki jo lahko baterija uskladišči. Energija je odvisna od pretečenega toka in napetosti. Če bi bila napetost baterije konstanta, bi jo enostavno pomnožili s kapaciteto, ker pa napetost s praznjenjem pada, je treba pointegrirati krivuljo odvisnosti napetosti baterije od pretečenega naboja. Med dvema baterijama z isto kapaciteto bo tista z višjo napetostjo shranila več energije. Zato s staranjem baterija zaradi sesedanja napetosti shrani čedalje manj energije, četudi njena kapaciteta ne bi upadala (pa se dogaja tudi slednje). Pri načrtovanju nas seveda zanima specifična energija glede na maso ali prostornino baterije.


Mikroskopski posnetek s 550x povečavo plošče v svinčevem akumulatorju. V novem akumulatorju (levo) je amorfni svinčev sulfat naložen v gobasti obliki, a se sčasoma pretvori v kristaliničnega (desno) z manjšo specifično površino, zaradi česar se zmanjšata kapaciteta akumulatorja. Vir: Canadus.com
Na koncu nam ostane še moč. Baterija mora biti sposobna zagotavljati energijo dovolj hitro, to v praksi pomeni, da mora biti sposobna proizvesti dovolj visok tok, ne da bi se napetost preveč sesedla. Slednja se vedno zniža s priklapljanjem bremena, želimo pa, da je napetostni padec čim manjši. Mikroskopsko gledano ima baterija visoko moč, če lahko elektrodne reakcije tečejo hitro in če se lahko ioni hitro premikajo skozi elektrolit. Ker reakcije tečejo na stiku elektrode z elektrolitom, je pomembno, da imajo baterije čim večjo elektrodno površino. Največjo površino imajo amorfne trdnine, zato kristalizacija elektrolita ali elektrodnega materiala kapaciteto znižuje. Prav tako je pomembno, da imajo ioni v elektrolitu visoko mobilnost. Spet je za inženirje najpomembnejša moč na enoto mase.
Spominski učinek
Zloglasni spominski učinek je v 60. in 70. letih odkrila NASA v NiCd baterijah, ki so jih uporabljali v svojih satelitih. Ti so krožili po predvidljivih orbitah okrog Zemlje in bili izpostavljeni popolnoma enakim obremenitvam, zato so bili njihovi cikli praznjenja, ko so bili v senci, in polnjenja enaki. Baterija si je »zapomnila« te cikle in je kasneje ni bilo mogoče uporabljati dlje, čeprav bi teoretično morala imeti večjo kapaciteto. Raziskave so pokazale, da se je na elektrodah nabral kristalinični kadmijev hidroksid, ki je imel bistveno manjšo površino od amorfnega, zato se je zmogljivost zmanjšala.
Pri vsakdanji rabi spominskega učinka ni mogoče poustvariti, ker cikli praznjenja in polnjenje niso nikoli enaki. Kot spominski učinek površno imenujemo upad napetosti (voltage depression) baterije s staranjem. To krmilna elektronika, ki napetost preračunava v stanje napolnjenosti, napačno interpretira, zato prehitro preventivno izključi napravo. Baterija ima še vedno svojo energijo, le da ima nekoliko nižjo napetost. To je problem krmilne elektronike, ne pa celic baterije.
Drugi problem pa je klasično staranje baterije, ko se kapaciteta zmanjšuje zaradi defektov v elektrodah in stranskih reakcij, ki se dogajajo v bateriji. V Li-ion baterijah elektrode počasi nepovratno oksidirajo in tu ne moremo storiti ničesar. Stanje še poslabšajo prenapolnjenje, čezmerna izpraznitev, preobremenitev in temperaturni ekstremi. Toda to ni spominski učinek.
Idealna baterija
Žal je ni, a si kljub temu oglejmo, katerim idealom se skušamo približati, poleg tega da želimo čim višje številke pri kvantitativnih karakteristikah iz prejšnjega odseka. Idealna baterija ima elektrodi z visoko razliko elektrodnih potencialov, kar zagotavlja visoko napetost, in nizko gostoto ter visoko poroznost. Elektrolit mora omogočati dobro mobilnost ionov, obenem pa mora biti elektronski izolator, da se izognemo notranjim kratkim stikom. Obenem mora biti elektrolit stabilen, odporen za nihanja temperature in po možnosti v trdnem agregatnem stanju (to je v nasprotju z željo po mobilnosti, zato se zadovoljimo z različnimi geli). Posebna pozornost je namenjena tesnjenju in varnosti, predvsem reakcijam, ki stečejo ob čezmernem polnjenju, čezmerni izprazniti, izpostavitvi visoki temperaturi in podobnem. Želimo si še, da ima baterija idealno karakteristiko, kar pomeni, da je njena napetost konstantna ves čas, potem pa hipno pade na nič, ko se baterija izprazni, da ima nizek notranji upor (zanemarljiv padec napetost ob priključitvi bremena), da nima spominskega učinka in da se čim počasneje stara. To so zelo stroge zahteve, sploh glede na prostorske in finančne omejitve v modernih napravah.
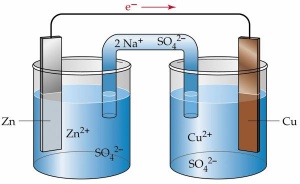
Shematski prikaz Li-ion baterije. Anoda je sestavljena iz plasti grafita, med katerimi so v polni bateriji litijevi ioni. Pri praznjenju potujejo skozi elektrolit do plasti kovinskega oksida (na shemi litijev kobaltat), med katere se vgradijo. Da zagotovimo elektronevtralnost, elektroni potujejo v isti smeri skozi zunanje vezje, kar povzroča električni tok za napajanje naprav. Vir: Science
Vrste baterij
Primarne baterije so cenejše in imajo običajno večjo kapaciteto od sekundarnih. Na tem mestu omenimo le dve vrsti, in sicer alkalne in srebrove. V alkalnih baterijah je anoda cinkova, katoda pa iz manganovega dioksida. Ime jim daje elektrolit, ki je močno alkalen kalijev hidroksid. Pri praznjenju te baterije se cink oksidira v cinkov(II) oksid, manganov dioksid pa reducira v manganov(III) oksid. Njihova napetost je okrog 1,5 V, kapaciteta baterije AA pa okrog 3000 mAh. Sposobne so zagotavljati sorazmerno nizke tokove, tipično manj od ampera.
Uporabljajo se tudi dražje srebrove baterije, ki jih poznamo iz ročnih ur, kalkulatorjev in slušnih aparatov. Te so dražje, a imajo bistveno višjo kapaciteto. Namesto manganovega dioksida uporabljajo srebrov(I) oksid, imajo nekoliko višjo napetost in višjo specifično kapaciteto.
V glavnem pa nas zanimajo sekundarne baterije, ki ne poganjajo le naših pametnih telefonov in prenosnih računalnikov, temveč tudi sisteme za zagotavljanje nepretrganega napajanja, električna vozila ipd. Omejili se bomo na svinčene akumulatorje, nikelj-kadmijeve (NiCd), nikelj-metalhidridne (NiMH) in litij-ionske baterije (Li-ion).
O svinčenem akumulatorju povejmo le, da se že sto let konceptualno ni spremenil. Je poceni, a zmore shraniti le malo energije glede na svojo maso. V avtomobilih se uporabljajo predvsem zato, ker so sposobni zagotoviti dovolj visoko moč za zaganjač in ker so poceni ter enostavni. Če ga alternator preveč napolni, voda z elektrolizo razpade na vodik in kisik, ki odhlapita. V tem primeru je treba zgolj doliti nekaj vode. Napolnjenost kontroliramo z merjenjem gostote, saj pri praznjenju akumulatorja nastaja voda, pri polnjenju pa skoraj dvakrat gostejša žveplena kislina.
NiCd baterije so bile do pred dvajsetimi leti glavna vrsta polnilnih baterij. V njih je anoda iz kadmija, ki se ob praznjenju raztaplja v kadmijev(II) hidroksid, katoda iz nikljevega(III) oksidhidroksida pa se reducira v nikljev(II) hidroksid. Elektrolit je kalijev hidroksid. Danes jih uporabljamo manj, ker shranijo manj energije od novejših baterij in ker je kadmij strupen.
NiMH baterije pa so še vedno zelo priljubljene, čeprav so jih v zabavni elektroniki skorajda v celoti izpodrinile Li-ion. V baterijah NiMH je katoda enaka kot v NiCd, medtem ko je anoda kar vodik, ki je ujet v kovino (zmes lantana, cerija, neodimija, prazeodimija, niklja, kobalta, mangana in aluminija). Novejše baterije Li-ion so zgrajene povsem drugače. Na katodi najdemo plastovit kovinski oksid (običajno litijev kobaltat(V)), anoda pa je navadno grafitna. Pri praznjenju litijevi ioni potujejo iz grafitne anode v katodo in se tam vgrajujejo v litijev kobaltat. Pri polnjenju se litijevi ioni vgrajujejo med plasti grafita na anodi. Na voljo je še vrsta drugih variacij, ki uporabljajo različne primesi in nosilne materiale, vsem pa je skupno, da po elektrolitu potujejo litijevi ioni.
Dandanes so baterije Li-ion najbolj priljubljene zato, ker se je njihova cena dovolj znižala, da odtehtajo njihove prednosti. Te so zlasti visoka specifična kapaciteta, visoka napetost celice in odsotnost spominskega učinka. Da je litij za izdelavo baterij najprimernejši, zna povedati že vsak srednješolec, ker ima ta kovina daleč najnižjo gostoto in najvišji elektrodni potencial. Problem je bilo le ukrotiti njegovo reaktivnost, to je uspelo šele z Li-ion baterijami.
Polnjenje
O polnjenju baterij kroži toliko mitov in različnih teorij, da smo upravičeno zmedeni in nezaupljivi. Nekako je vsem jasno, da prepogosto polnjenje in polnjenje prek zgornje meje (overcharging) škodujeta in da visoke temperature še na nobeno elektronsko komponento niso blagodejno vplivale. V praksi pa mobilni telefon na priloženi polnilec priključimo čez noč, prenosne računalnike pa kar stalno, ko so v pisarnah.
Manj znano pa je, da je za dolgoživost baterije ključnega pomena polnilec, saj cenen kitajski polnilec ali stari polnilec za kako drugo vrsto baterij povzroči velikansko škodo, ki jo potem neupravičeno pripisujemo slabi kakovosti baterij. NiCd, NiMH in Li-ion baterije imajo različne karakteristike, zato so režimi polnjenja povsem drugačni in terjajo rabo različnih polnilcev. Ti se dalje delijo na industrijske in osebne; mi se bomo omejili na slednje, ki imajo spet vrsto podskupin.
Polnilci morajo biti vsaj sposobni določiti, kdaj je baterija polna, priporočljivo pa je, da znajo tudi v vmesnih korakih oceniti stopnjo napolnjenosti. To počno v glavnem z merjenjem napetosti na bateriji, v NiCd in NiMH pa je pomemben podatek še temperatura baterije.
Hitrost polnjenja podajamo v enotah C, kjer 1C pomeni napolnitev do polne kapacitete v eni uri, 0,1C pa v desetih urah. Za NiCd baterije so na voljo zelo preprosti počasni polnilci (0,1C), ki so namenjeni polnjenju čez noč in nimajo senzorjev. Hitri polnilci so nekoliko hitrejši (od 0,3C do 1C), zato potrebujejo senzorje za stanje baterije. Napetost NiCd baterij se malenkostno zniža, tik preden so polne, hkrati pa temperatura zelo naraste, kar je znak za konec polnjenja. V NiMH baterijah je padec napetosti manj izrazit in s starostjo izzveni, zato se uporablja kombinacija pogojev (temperatura, hitrost spremembe temperature v časovni enoti, končna napetost). Polnilci za baterije NiMH so sposobni varno polniti baterije NiCd, nasprotno pa ne velja. Razlog je v večji občutljivost prvih, ki slabo prenašajo prenapolnjenje in jim prepočasno polnjenje škodi, NiCd pa so za ta dva dejavnika manj občutljive.
Li-ion baterije so precej bolj občutljive za okoliščine polnjenja, zato so zanje posebni polnilci. Njihov napetostni režim je precej tog, in sicer so polne pri 4,2 V. Polnjenje poteka v treh fazah. V prvi fazi do približno 80-odstotne napolnjenosti skozi baterijo teče konstanten visok tok. V drugi fazi na vse celice pritisnemo ciljno napetost (4,2 V), torej se polnijo pri konstanti napetosti in padajočem toku, dokler ta ne pade na tri odstotke nazivnega toka iz prve faze. Tedaj je baterija polna. Li-ion baterije morajo biti ves čas polnjenja hladne, drugače je to znak, da ne uporabljate pravega polnilca in jih uničujete.
Tretja faza nastopi, če baterija ostane priključena na polnilec in se dogaja tudi v pametnejših polnilcih za NiCd in NiMH. V tem primeru skoznjo teče le tok (trickle charging), ki ustreza hitrosti samoizpraznitve (self discharge). V vsakem primeru pride sčasoma do prenapolnjenja in četudi bi nam uspelo zagotavljati tok, ki je popolnoma enak samoizpraznitvenemu, bi se na elektrodah dogajale spremembe, ki znižujejo kapaciteto baterije. Ko je baterija polna, jo izključite!
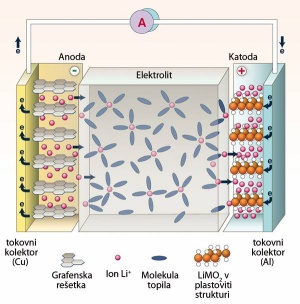
Napetost celic v bateriji se pri polnjenju zvišuje (vedenje NiMH je zelo podobno NiCd). Tik pred napolnitvijo napetost NiCd, NiMH in svinčevega akumulatorja malce upade. To je eden izmed znakov za konec polnjenja. Li-ion baterije, ki so še posebej občutljive za čezmerno polnjenje, tega učinka ne kažejo.
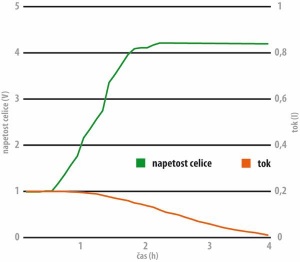
Li-ion baterijo polnimo najprej pri konstantnem toku do 80 % nazivne kapacitete, potem pa pri konstantni napetosti do točke, ko tok upade na tri odstotke začetnega toka. Konca cikla ne moremo zaznati z merjenjem temperature, ker se baterija ne segreva, ali padcem napetosti, ker ga ni. Ko se baterija postara, njena napetost upade, zato jo bo sčasoma polnilec polnil čez mero.
Napetost celic v bateriji se pri polnjenju zvišuje (vedenje NiMH je zelo podobno NiCd). Tik pred napolnitvijo napetost NiCd, NiMH in svinčevega akumulatorja malce upade. To je eden izmed znakov za konec polnjenja. Li-ion baterije, ki so še posebej občutljive za čezmerno polnjenje, tega učinka ne kažejo.
Razvoj litijevih baterij
Prve litijeve baterije so uporabljale anodo iz kovinskega litija, kar ni bilo praktično zaradi nastajanja neenakomernih izrastkov (dendritov), ki so povzročali kratke stike. Kasneje so jim dodali aluminij, kar je odpravilo to težavo, a so bile te baterije občutljive za spremembo prostornine in so že po nekaj ciklih odpovedale. Sčasoma so za katodo začeli uporabljati litij-kovinske okside (LixMO2), kjer je M kobalt, nikelj ali mangan, anoda pa je bila iz titanovega disulfida.
Leta 1991 so litij-ionske baterije doživele velik preboj, ko je Sony na trg poslal baterijo z grafitno anodo in katodo iz litijevega kobaltata (LiCoO2) z gostoto energije, ki je bila od dva- do trikrat večja od tedaj priljubljenih baterij NiCd. Ker katoda z vsebnostjo kobalta zaradi strupenosti kobalta, visoke cene in sorazmerno nizke sposobnosti adsorpcije litijevih ionov ni najprimernejša, so razvili katodo iz litij-železovega fosfata (LiFePO4), ki teh težav nima, ima le nekoliko nižjo elektronsko prevodnost, to pa rešujejo z vgradnjo dodatkov. Najnovejše baterije imajo anodo iz silicija namesto grafita.
Razvoj se nadaljuje v smer litij-ionskih polimernih (LiPo) baterij, ki jih pričakujemo v naslednjih dveh letih. Te so tanjše in lažje, a imajo trenutno še težave z nižjo zmogljivostjo in višjo ceno.
Praznjenje
Praznjenje je skoraj tako pomembno kot polnjenje, če želimo podaljšati življenjsko dobo baterije ali pa zgolj iztisniti iz nje čim več. Iz osnovne termodinamike vemo, da lahko sistem odda največ dela, kadar se giblje po reverzibilni poti, ki je neskončno počasna. Temu se najbolj približamo, če je breme na bateriji karseda nizko. Z drugimi besedami: čim hitreje praznimo baterijo, tem manj energije bomo iztisnili iz nje. To vidimo kot poslabšanje napetostne karakteristike, saj se zaradi notranjega upora zunanja napetost pod bremenom zniža. Prevelike tokovne zahteve pa lahko baterijo celo uničijo.
Še pomembnejša od hitrosti praznjenja pa je stopnja izpraznitve (depth of discharge). NiCd in NiMH celice v bateriji se izpraznijo do 1,0 V, Li-ion pa nekje do 3,0 V. Kar je nižje, škoduje bateriji, ker začno teči nezaželene ireverzibilne reakcije.
V praksi se lahko težave pojavijo že pri nekoliko višjih napetostih, zlasti ko imamo opraviti s starejšimi baterijami. Te so namreč sestavljene iz več celic, ki so vezane zaporedno. Če je ena izmed njih v slabšem stanju kot druge, kar se skoraj vedno zgodi, bo ta dokončno izpraznjena že pred preostalimi. Pri nadaljnji rabi v tem območju bo skoznjo tekel tok, ki jo bo še dodatno izpraznil, kar jo lahko uniči, s tem pa tudi celotno baterijo. Popolna izpraznitev (do meje) nikljevim baterijam ne škodi, Li-ionske pa je ne prenašajo najbolje.
Zanimivo je tudi opažanje, da se NiMH baterije bistveno slabše odrežejo v digitalnih napravah kot klasičnih analognih, čeprav je poraba nižja. To gre pripisati večji konični porabi (pulzno praznjenje), na katero so izredno slabo odporne, namesto kontinuirani umirjeni porabi. Li-ion in NiCd so nanjo odpornejše.
Prihodnost
Pri tehnologiji, ki jo bodo uporabljale baterije v naših napravah, nimamo kaj dosti izbire. Uporabimo pač tisto, kar je predvidel izdelovalec. Prav tako se moramo sprijazniti z dejstvom, da kljub upoštevanju vseh priporočil baterije ostajajo potrošni material, ki ga je treba vsakih nekaj let menjati. Prenosnik, na katerem je nastalo tole besedilo, poganja ista Li-ion baterija že deveto leto in je že tako uničena, da ne zdrži niti celotnega zagona operacijskega sistema.
Zanimiv pa je pogled v prihodnost, kjer se nakazujeta dve poti. Po eni strani znanstveniki razvijajo nove vrste baterij. Litij-ionske polimerne (LiPo) baterije so že skoraj tu in jih lahko pričakujemo v naslednjem letu ali dveh, saj so zgolj nadgradnja Li-ion tehnologije. O odkritju nove tehnologije, ki v prihodnosti napoveduje dvakrat ali desetkrat zmogljivejše baterije, beremo skorajda vsak mesec, a teh izdelkov potem čudežno ni. To ne pomeni, da napredka ni, le da je precej počasen in predvsem postopen, skokov pa ni pričakovati. Stanje se zdi slabše, kot je v resnici, samo zato, ker naše potrebe po energiji naraščajo tako hitro kot zmogljivosti baterij. Če bi staro Nokio izpred desetih let priključili na današnje Li-ion baterije, bi brez težav zdržala mesec dni! Štirijedrni procesorji in gigabajti pomnilnika pač terjajo svoje.

V električne avtomobile vgrajujejo velike Li-ion baterije z nekaj tisočkrat večjo zmogljivostjo kot v prenosnih računalnikih. Na fotografiji komplet baterij z zmogljivostjo 24 kWh za Nissan Leaf. Vir: Nissan
Konkurenčni tehnologiji sta superkondenzator in gorivna celica, ki prav tako uporabljata po dve elektrodi in raztopino elektrolita. Razlika med baterijo in gorivno celico je v zaprtosti sistema. Medtem ko v baterijo snovi ne dodajamo ali jih odvzemamo iz nje, v gorivne celice teče gorivo, ki sodeluje v redukcijsko-oksidacijskih reakcijah na elektrodah. Značilen zgled je gorivna celica na vodik in kisik. Energija je v obeh primerih shranjena v kemijskih vezeh. Superkodenzatorji energijo hranijo kot statično elektriko (naboj na ploščah). So križanci med mokro baterijo in šolskim ploščatim kondenzatorjem, saj uporabljajo elektrode iz ogljika z visoko površino, kovinskega oksida ali prevodnega polimera ter vodni ali organski elektrolit. Njihova kapaciteta dosega vrednost nekaj faradov, kar predstavlja približno desetino energije klasičnih NiMH baterij. Njihove prednosti so praktično neomejeno število ciklov, nizka impedanca, hitro polnjenje in nizka cena, slabost pa nižja gostota energije, linearni upad napetosti s praznjenjem (po polovici porabljene energije je napetost samo še polovica začetne) in visoka stopnja samoizpraznitve, ki terja redno polnjenje.
V prihodnosti bomo v prenosnih napravah verjetno še naprej videvali baterije, a bodo shranile več energije in imele še prijaznejše karakteristike od trenutnih. Za nišne uporabe pa se bodo uveljavili tudi gorivne celice in superkondenzatorji. In baterije bodo zelo verjetno še dolgo ostale potrošni material.
Tančica skrivnosti
V preteklosti smo za določene baterije empirično ugotovili, da odlično delujejo, in opisali njihove značilnosti, kemija v njih pa je bila neznanka. NiCd baterije poznamo že od leta 1898, a vse do 60. let niso podrobno poznali reakcij, ki tečejo v njih. Šele spektroskopija IR je razrešila ta problem. Danes pri razvoju baterij uporabljajo tudi elektronske mikroskope, s katerimi si lahko ogledajo površino elektrod z ločljivostjo posameznih atomov.
Tako kemijsko delujejo današnje baterije:
Svinčev akumulator: Pb + PbO2 + 2 H2SO4 → 2 PbSO4 + 2 H2O
NiCd: 2 NiO(OH) + Cd + 2 H2O → 2 Ni(OH) 2 + Cd(OH) 2
NiMH: NiO(OH) + MH + H2O → Ni(OH)2 + M + H2O
MH je medkovinska spojina sestave XY5, kjer je X lantan, cerij, neodimij ali prazeodimij, Y pa nikelj, kobalt, mangan ali aluminij.
Li-ion: LiCoO2 + 6x C → x LiC6 + Li1-xCoO2